2023 ASCO | 伊尼妥單抗聯合TKI治療HER2突變晚期NSCLC患者Ib期研究公布:DCR(疾病控制率)達85.4%!
2023-05-31
2023年美國臨床腫瘤學會(ASCO)年會將于2023年6月2日至6日在美國伊利諾伊州芝加哥以線上線下混合會議形式舉行。5月26日,ASCO公布了此次年會部分入選研究的摘要內容,伊尼妥單抗(賽普汀®)有多項臨床研究入選!其中一項由中山大學腫瘤防治中心方文峰教授團隊開展的針對HER2基因突變的非小細胞肺癌(NSCLC)的Ib期研究(NCT 05016544)初步分析結果表明:伊尼妥單抗(賽普汀®)聯合吡咯替尼治療HER2基因突變的NSCLC患者耐受性良好,其中320mg組療效更佳。
研究題目:伊尼妥單抗聯合吡咯替尼治療HER2突變型非小細胞肺癌(NSCLC)的安全性和療效研究:一項開放標簽的Ib期研究
研究背景:
目前,HER2突變型NSCLC患者的靶向治療研究證據有限。此前研究表明,吡咯替尼對HER2突變的晚期NSCLC患者具有抗腫瘤活性。伊尼妥單抗是一種重組的人源化抗HER2單克隆抗體,與曲妥珠單抗具有相同的Fab段,Fc段2個氨基酸位點進行修飾。伊尼妥單抗聯合吡咯替尼是否能顯示出可控的安全性和有效的抗腫瘤活性尚不清楚。故研究旨在評估伊尼妥單抗聯合吡咯替尼治療晚期非小細胞肺癌HER2突變患者的安全性和有效性。
研究方法:
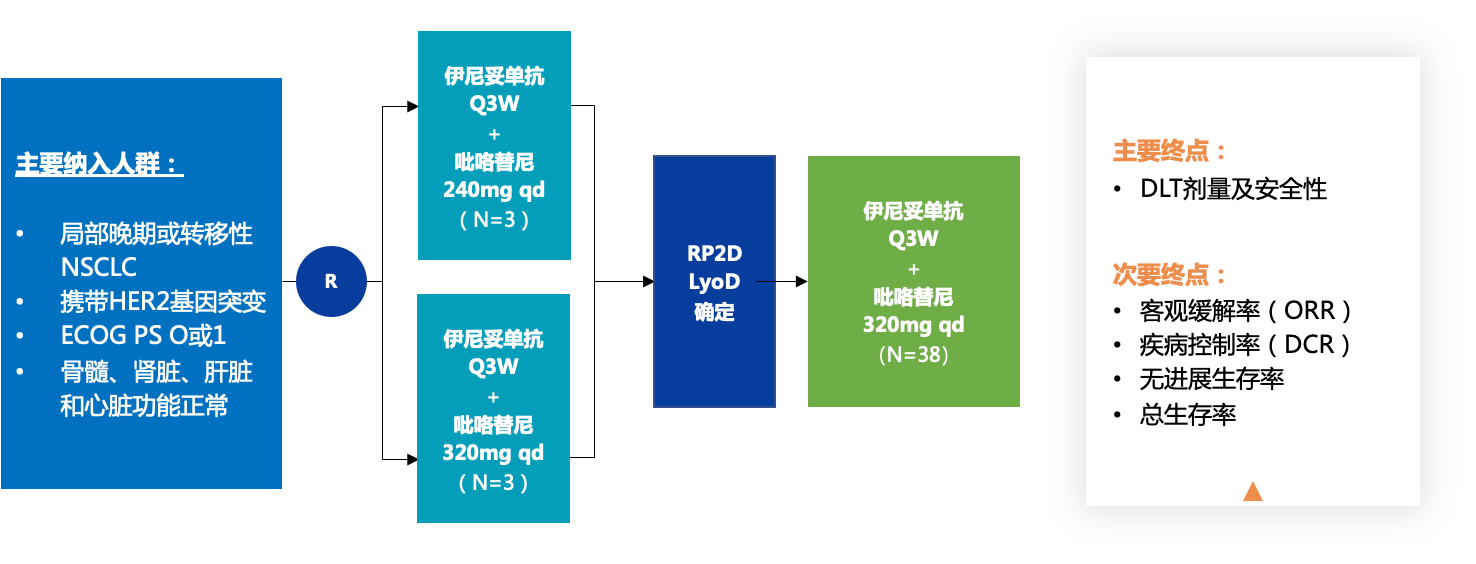
該研究是一項開放標簽的Ib期研究。攜帶HER2基因突變的局部晚期或轉移性NSCLC患者接受伊尼妥單抗聯合吡咯替尼方案治療。該研究由劑量遞增部分和劑量擴展部分組成。在劑量遞增期間,采用平行的“3+3”劑量遞增設計來確定劑量限制毒性(DLT)。伊尼妥單抗采用3周給藥方案(第1周期為8 mg/kg負荷劑量,后續各周期為6 mg/kg),同時予吡咯替尼(劑量遞增部分,240 mg qd,320 mg qd;劑量擴大部分,320 mg qd)。研究的主要終點是DLT的劑量和安全性。在第一次給藥后的21天內評估DLT。次要終點包括客觀緩解率(ORR)、疾病控制率(DCR)、無進展生存率和總生存率。
研究結果:
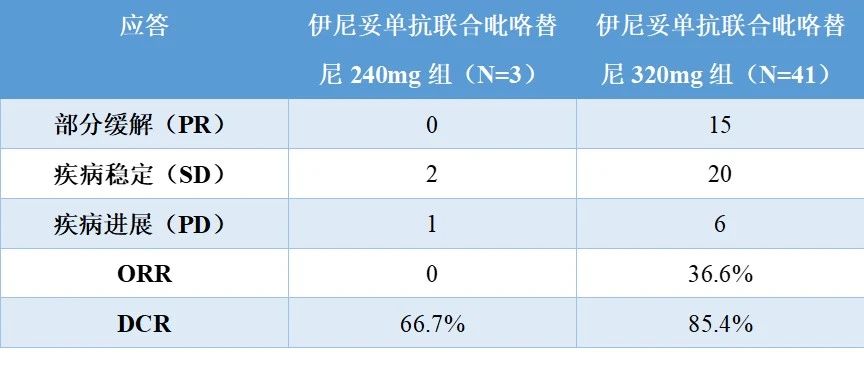
2021年8月6日至2022年8月25日,共納入44例患者,其中3例為伊尼妥單抗聯合240mg吡咯替尼組,41例為伊尼妥單抗聯合320mg吡咯替尼組。吡咯替尼240mg和320mg遞增期未發生DLT。因此,選擇吡咯替尼320mg作為擴張劑量研究。最常見的治療相關不良事件(TRAE)是腹瀉(240 mg組為66.7%[2/3],320 mg組為95.6%[43/45])、皮疹(240 mg的66.7%[2/3]、320 mg的22.2%[10/45])和嘔吐(240 mg為0,320 mg的24.4%[11/45])。TRAEs一般為1-2級。只有7名患者報告了3級TRAEs(240 mg吡替尼組1例,320 mg吡替替尼組6例)。初步療效如下表所示。伊尼妥單抗聯合吡咯替尼240mg組的ORR和DCR分別為0%和66.7%。伊尼妥單抗聯合吡咯替尼320mg組的ORR和DCR分別為36.6%和85.4%,中位PFS為5.5個月(95%CI,4.4-8.6個月)。
研究結論:
伊尼妥單抗聯合吡咯替尼的初步數據顯示,在攜帶HER2突變的晚期NSCLC患者中,具有可觀的抗腫瘤活性。同時不良反應較少,安全可控。
Wenfeng Fang, Yuanyuan Zhao, Yan Huang, et al. Safety and efficacy of inetetamab in combination with pyrotinib in HER2 mutant patients with non-small cell lung cancer (NSCLC): An open-label, phase Ib trial. J Clin Oncol 41, 2023 (suppl 16; abstr 9105)
關于賽普汀®:
賽普汀®(伊尼妥單抗)是中國首個獲批上市的創新抗 HER2 單抗,與化療藥物聯合,可用于治療HER2 陽性的轉移性乳腺癌患者。作為國家“十二五”生物制藥重大專項項目,伊尼妥單抗于 2020 年 6 月獲得 NMPA 批準上市,其上市打破了外資藥企長達 18 年的抗HER2 單抗壟斷地位,有力地推進了中國抗體生物藥的自主研發熱潮。2020 年 12 月底,伊尼妥單抗通過了醫保談判,首次被納入《國家基本醫療保險、工傷保險和生育保險藥品目錄(2020 年版)》。目前,伊尼妥單抗被正式納入 CSCO 乳腺癌診療指南和 CACA-CBCS 指南等國內權威指南,成為晚期乳腺癌全程抗 HER2 治療的基礎藥物,在 2023 版CSCO 乳腺癌診療指南中被列為 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治療的 I 級推薦用藥。
關于三生國健
三生國健是中國首批專注于創新型抗體藥物研究并持續積極創新,擁有研、產、銷一體化成熟平臺,專注于單抗、雙抗、多抗及多功能重組蛋白等新技術研究。公司擁有超過18年大規模抗體產業化和質量控制經驗,并多維度布局CDMO業務,鞏固和增強創新型治療藥物企業的領導地位。目前,公司擁有13個處于不同開發階段的在研創新藥物,其中大部分在研藥物為治療用生物制品1類,部分在研藥物為中美雙報。請訪問www.3s-guojian.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。

摘(zhai)要號:9105
研究題目:伊尼妥單抗聯合吡咯替尼治療HER2突變型非小細胞肺癌(NSCLC)的安全性和療效研究:一項開放標簽的Ib期研究
研究背景:
目前,HER2突變型NSCLC患者的靶向治療研究證據有限。此前研究表明,吡咯替尼對HER2突變的晚期NSCLC患者具有抗腫瘤活性。伊尼妥單抗是一種重組的人源化抗HER2單克隆抗體,與曲妥珠單抗具有相同的Fab段,Fc段2個氨基酸位點進行修飾。伊尼妥單抗聯合吡咯替尼是否能顯示出可控的安全性和有效的抗腫瘤活性尚不清楚。故研究旨在評估伊尼妥單抗聯合吡咯替尼治療晚期非小細胞肺癌HER2突變患者的安全性和有效性。
研究方法:
該研究是一項開放標簽的Ib期研究。攜帶HER2基因突變的局部晚期或轉移性NSCLC患者接受伊尼妥單抗聯合吡咯替尼方案治療。該研究由劑量遞增部分和劑量擴展部分組成。在劑量遞增期間,采用平行的“3+3”劑量遞增設計來確定劑量限制毒性(DLT)。伊尼妥單抗采用3周給藥方案(第1周期為8 mg/kg負荷劑量,后續各周期為6 mg/kg),同時予吡咯替尼(劑量遞增部分,240 mg qd,320 mg qd;劑量擴大部分,320 mg qd)。研究的主要終點是DLT的劑量和安全性。在第一次給藥后的21天內評估DLT。次要終點包括客觀緩解率(ORR)、疾病控制率(DCR)、無進展生存率和總生存率。
研究設計
研究結果:
2021年8月6日至2022年8月25日,共納入44例患者,其中3例為伊尼妥單抗聯合240mg吡咯替尼組,41例為伊尼妥單抗聯合320mg吡咯替尼組。吡咯替尼240mg和320mg遞增期未發生DLT。因此,選擇吡咯替尼320mg作為擴張劑量研究。最常見的治療相關不良事件(TRAE)是腹瀉(240 mg組為66.7%[2/3],320 mg組為95.6%[43/45])、皮疹(240 mg的66.7%[2/3]、320 mg的22.2%[10/45])和嘔吐(240 mg為0,320 mg的24.4%[11/45])。TRAEs一般為1-2級。只有7名患者報告了3級TRAEs(240 mg吡替尼組1例,320 mg吡替替尼組6例)。初步療效如下表所示。伊尼妥單抗聯合吡咯替尼240mg組的ORR和DCR分別為0%和66.7%。伊尼妥單抗聯合吡咯替尼320mg組的ORR和DCR分別為36.6%和85.4%,中位PFS為5.5個月(95%CI,4.4-8.6個月)。

研究結論:
伊尼妥單抗聯合吡咯替尼的初步數據顯示,在攜帶HER2突變的晚期NSCLC患者中,具有可觀的抗腫瘤活性。同時不良反應較少,安全可控。
Wenfeng Fang, Yuanyuan Zhao, Yan Huang, et al. Safety and efficacy of inetetamab in combination with pyrotinib in HER2 mutant patients with non-small cell lung cancer (NSCLC): An open-label, phase Ib trial. J Clin Oncol 41, 2023 (suppl 16; abstr 9105)
關于賽普汀®:
賽普汀®(伊尼妥單抗)是中國首個獲批上市的創新抗 HER2 單抗,與化療藥物聯合,可用于治療HER2 陽性的轉移性乳腺癌患者。作為國家“十二五”生物制藥重大專項項目,伊尼妥單抗于 2020 年 6 月獲得 NMPA 批準上市,其上市打破了外資藥企長達 18 年的抗HER2 單抗壟斷地位,有力地推進了中國抗體生物藥的自主研發熱潮。2020 年 12 月底,伊尼妥單抗通過了醫保談判,首次被納入《國家基本醫療保險、工傷保險和生育保險藥品目錄(2020 年版)》。目前,伊尼妥單抗被正式納入 CSCO 乳腺癌診療指南和 CACA-CBCS 指南等國內權威指南,成為晚期乳腺癌全程抗 HER2 治療的基礎藥物,在 2023 版CSCO 乳腺癌診療指南中被列為 HER2+晚期乳腺癌 H 敏感患者抗 HER2 治療的 I 級推薦用藥。
關于三生國健
三生國健是中國首批專注于創新型抗體藥物研究并持續積極創新,擁有研、產、銷一體化成熟平臺,專注于單抗、雙抗、多抗及多功能重組蛋白等新技術研究。公司擁有超過18年大規模抗體產業化和質量控制經驗,并多維度布局CDMO業務,鞏固和增強創新型治療藥物企業的領導地位。目前,公司擁有13個處于不同開發階段的在研創新藥物,其中大部分在研藥物為治療用生物制品1類,部分在研藥物為中美雙報。請訪問www.3s-guojian.com獲取更多信息。
警示說明及前瞻性陳述
本新聞稿包含前瞻性陳述,例如涉及業務和產品前景,或公司的意圖、計劃、認知、預期及策略。該等前瞻性陳述是根據本公司現有的資料,并按本新聞稿發布時的展望陳述。該等前瞻性陳述基于若干預測、假設及前提,其中一些是主觀性的或不受我們控制。該等前瞻性陳述可能被證明是不正確的,或將來可能無法實現。就任何新產品或產品的新適應癥, 我們無法確保其將能成功開發或最終上市銷售。該等前瞻性陳述受各種風險及不明朗因素影響。我們的其他公開披露文件可能提供該等風險及不明朗因素的更多信息。所涉及之科學信息可能只是初步的和研究性的。本公司股東及潛在投資者在買賣本公司股份時,請務必謹慎行事。